Problem korozji
Obecność zawartych w wodzie gazów dramatycznie podnosi agresywność środowiska wodnego. Niepożądanym efektem jest tutaj korozja układu.
Na korozję są szczególnie narażone są urządzenia i części konstrukcyjne wykonane ze stali.
- W temperaturach powyżej 400˚C między żelazem a parą przebiega reakcja chemiczna, w wyniku której żelazo utlenia się i powstaje tlenek żelaza magnetyt Fe3O4
- W temperaturach powyżej 570˚C dochodzi do powstania tlenku żelazawego FeO
- Tlenek żelazowy Fe2O3 jest w warunkach panujących w przestrzeni parowej nietrwały i stopniowo przekształca się w FeO lub Fe3O4
Z wyżej wymienionych tlenków jedynie magnetyt (Fe3O4) jest stabilnym i pożądanym tlenkiem.
Jego cienka warstewka na wewnętrznej powierzchni elementów grzewczych kotła zabezpiecza powierzchnię metalu przed dalszą korozją.
W zależności od czynników oddziaływujących na metal, rozróżnia się
- Korozję chemiczną – typowym przykładem jest rozkład przegrzanej pary wodnej. Szczególnie narażone są rury opłomkowe, rury przegrzewaczy oraz miejsca, gdzie może dojść do powstania korków parowych
- Korozję tlenową (wżerową) – wywołaną obecnością rozpuszczonego tlenu
- Korozję wywołaną obecnością dwutlenku węgla CO2 – szczególnie agresywną przy obecności tlenu; jest to korozja równomierna
Zagrożenia
W warunkach panujących w kotle, żelazo jest materiałem nietrwałym. Jednak zastosowanie żelaza do budowy kotłów jest możliwe dzięki ochronnemu działaniu warstwy magnetytu.
Odporność metalowych elementów konstrukcji zależy bezpośrednio od właściwości tej warstewki, od jej odporności na działanie czynników chemicznych i fizycznych.
Szczególnie niszcząco na warstewkę magnetytu działają zmiany temperatury. Wskutek różnic rozszerzalności cieplnej magnetytu i stalowych ścianek kotła, warstewka ochronna staje się krucha, pęka i łuszczy się – umożliwia ponowną reakcję wody z odkrytą powierzchnią metalu.
W wyniku reakcji wydziela się wodór i powstają niekorzystne tlenki, nie chroniące stali, nie hamujące korozji i dalej się złuszczające – korozja postępuje, aż do uszkodzenia stali.
Porywane z wodą łuski tlenków mają naturalną tendencję do gromadzenia się w pobliżu kolanek, ukośnych/poziomych elementów instalacji, zmniejszając lub zamykając przepływ w rurach. Zatkane rury są szczególnie narażone na przepalanie.
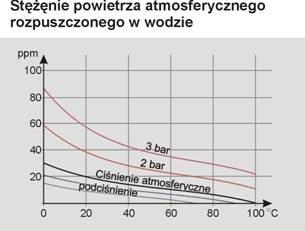
Korozja tlenowa wywołana obecnością rozpuszczanych w wodzie gazów jest korozją elektrochemiczną. W miarę wzrostu temperatury rozpuszczalność gazów w wodzie maleje, zwiększa się jednak wraz ze wzrostem ciśnienia.
W układach zamkniętych, np. w obiegu ciepłowniczym, gdzie rozpuszczone w wodzie gazy nie mogą się swobodnie wydobywać, szybkość korozji rożnie proporcjonalne ze wzrostem temperatury.
W układach otwartych korozja osiąga maksimum przy ok. 70˚C, malejąc wraz ze wzrostem temperatury.
Metale stosowane w technice zawierają dodatki innych metali lub niemetali. W obecności elektrolitu (zanieczyszczonej wody) tworzą się w nich mikroogniwa elektryczne.
Tlen objawia swoje niekorzystne działanie jako depolaryzator, umożliwiając tym samym ciągły postęp korozji.
Korozję wywołuje także dwutlenek węgla CO2, którego agresywność wzrasta w obecności tlenu.
Przyczynia się do korozji powierzchniowej, równomiernej, a produkty korozji zwiększają ilość osadów krążących w obiegu. Powstające osady wtórne czopują rury.
Wnioski
Wyeliminowanie gazów z wody, również w szczątkowych ilościach, jest podstawowym obowiązkiem inżyniera odpowiedzialnego za pracę układu
Preparaty chemiczne od Global Concepts 2000 Polska
Produkt polimerowy – inhibitor powstawania kamienia kotłowego, nielotny, dopuszczony do stosowania w przemyśle spożywczym. Posiada atest PZH.
Produkt do usuwania zanieczyszczeń z membran RO. Posiada atest PZH.
Jego działanie polega na hamowaniu powstawania tlenków metali (korozji), poprzez tworzenie strefy strącania oraz dyspersję.
Produkt do usuwania zanieczyszczeń z membran RO. Posiada atest PZH




